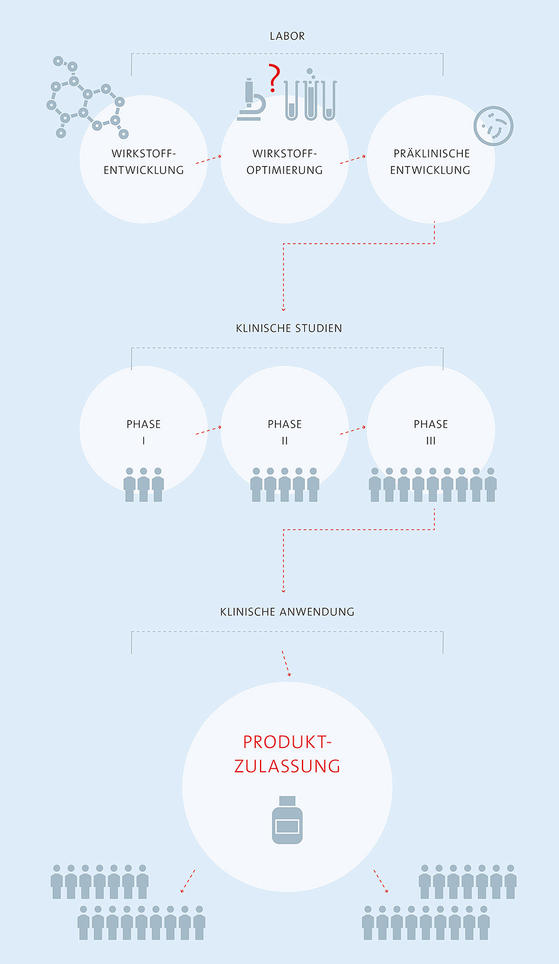
Präklinische Forschung
In der präklinischen Forschung werden Wirkmechanismus, Zusammensetzung und Stabilität des Wirkstoffs zunächst im Labor getestet. Es folgen Versuche im Tiermodell, in denen geprüft wird, ob das Präparat wirksam ist und ob Nebenwirkungen auftreten.
Phase 1
Klinische Studien teilen sich in vier Phasen auf. In Phase 1 wird der Wirkstoff in der Regel an gesunden Freiwilligen (Probanden) getestet, um festzustellen, wie er sich im Körper verhält; verschiedene Dosierungen werden untersucht.
Phase 2
In Phase 2 erhält eine begrenzte Gruppe von Patienten das Präparat, um festzustellen, ob es wirksam und verträglich ist. Mögliche Nebenwirkungen sollen identifiziert werden und es geht darum, eine geeignete Dosierung zu finden. Diese Phase kann sich über zwei, drei oder mehrere Studien erstrecken.
Phase 3
Studien der Phase 3 sind randomisierte, kontrollierte und prospektive Studien, die für Arzt und Patient verblindet sind. Ein Teil der Patienten erhält das neue Medikament, der andere wird mit einer bereits vorhandenen Therapie (Vergleichstherapie) behandelt oder bekommt Placebo. Am Ende werden die Ergebnisse verglichen.
Produkt-Zulassung
Bei erfolgreich abgeschlossener Phase 3 folgt in der Regel die Zulassung. Eine Zulassung für ein neues Arzneimittel kann nur beantragt werden, wenn die therapeutische Wirksamkeit und Unbedenklichkeit sowie ein günstiges Nutzen-Risiko-Verhältnis belegt wurden.
Phase 4
In der Folgezeit schließen sich Studien der Phase 4 an, um zusätzliche Informationen zu Sicherheit und Wirksamkeit an großen Patientenzahlen unter Alltagsbedingungen zu gewinnen.